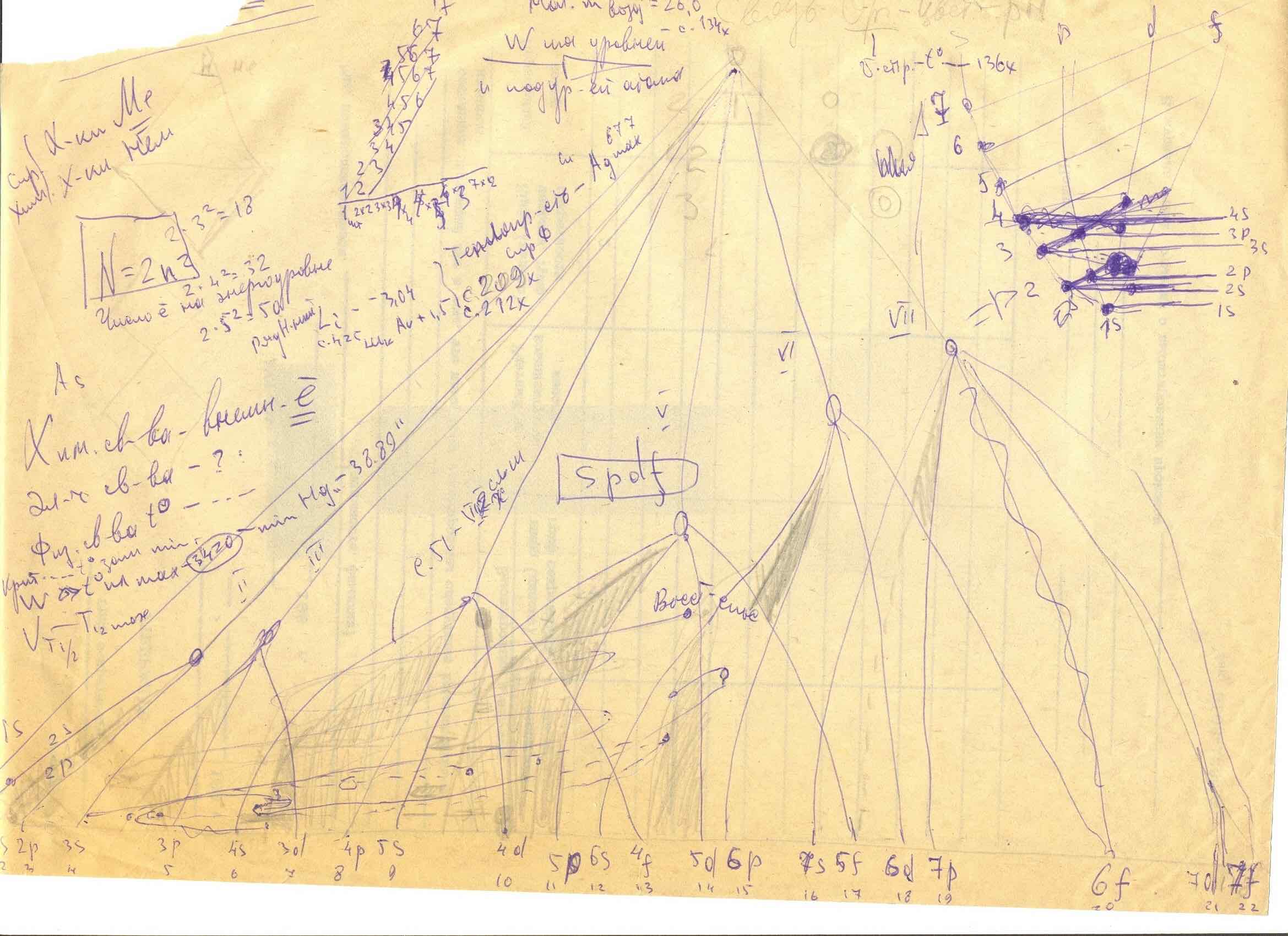
Таблица энергоуровней химэлементов!
Тот должен много изучать и создавать.
//По материалам изображений таблицы элементов Менделеева.//
Периодическая таблица химических элементов, созданная Д.И. Менделеевым имеет ряд показателей:
1) 1 – 7 периоды;
2) Ш – VIII группы («а» и «б» каждая) ;
3) Порядковые номера элементов (атомные веса) от 1 до 118 (на сегодняшний день формула физики о плураспадах элементов … позволяет предположить 118 элементов таблицы, так как время полураспада становится равным времени жизни со 119 по 128 элемент, ранее считавшийся последним);
4) 7 энергоуровней (1-7);
5) 4 подуровня(s, p, d, f - орбиты) , образующих
6) 22 энергосостояния:
1s1, 1s2, 2s1, 2s2, 2p1, …, 7 f ;
7) энергетические уровни атома определяются по формуле
Е(n) = - [m(е в степени 4)]/[2( h в степени 2)(n в степени 2)],
то есть c увеличением квантового числа энергия электронов орбиты падает;
8) радиусы возможных орбит электронов описываются формулой
R(n) = [(h в степени 2) (n в степени 2)]
и 2)], где h=(10 в степени минус 34) дж/с – постоянная Планка;
m= 9х(10 в степени (-31)) кг, e – заряд электрона по количественной теории атома Нильса Бора;
9) на каждой электронной оболочке можно поселить не более 2 электронов для s-оболочек
(s1, s2); не более 6 для p –оболочек (p1, p2, p3,…, p6), 10 – для d –оболочек (f 1, f 2, .., f 14) (принцип Паули);
10) f – оболочка в группах лантаноидов и актиноидов – имеют 14 оболочек (d1, d2, .., d10)
11) общее теоретическое число электронов (s, p, d, f):
7х2 + 6х6 + 5х10 + 4х14 = 128 минус пропски в таблице;
12) электронные оболочки изменяют направленность орбит: 2881), 2882), (21881, (28183.
Основным критерием при расположении системы данных параметров может быть энергия, причём она увеличивается по уровням (n) и подуровням от 1 до 7 и от (s) к (f) - (энергия ядра), но уменьшается с ростом N=2(n)х(n).
Свидетельство о публикации №124120906543